Chưa có sản phẩm trong giỏ hàng.
Kiến thức
Khí metan là gì? Trạng thái tự nhiên, tính chất, ứng dụng và cách điều chế
Thành phần chính của khí gas mà chúng ta đang sử dụng là Metan (CH4). Vậy khí metan là gì? Để hiểu rõ hơn về trạng thái tự nhiên, tính chất hoá học, ứng dụng và cách điều chế, hãy cùng Phukienong tìm hiểu trong bài viết dưới đây.
1. Khí Metan là gì?
Metan là một loại khí không màu, không mùi, không vị, nhẹ hơn không khí. Trong tự nhiên, nó có nhiều trong các giếng khí tự nhiên, giếng dầu, mỏ than, nhà máy xử lý nước thải và khí sinh học.
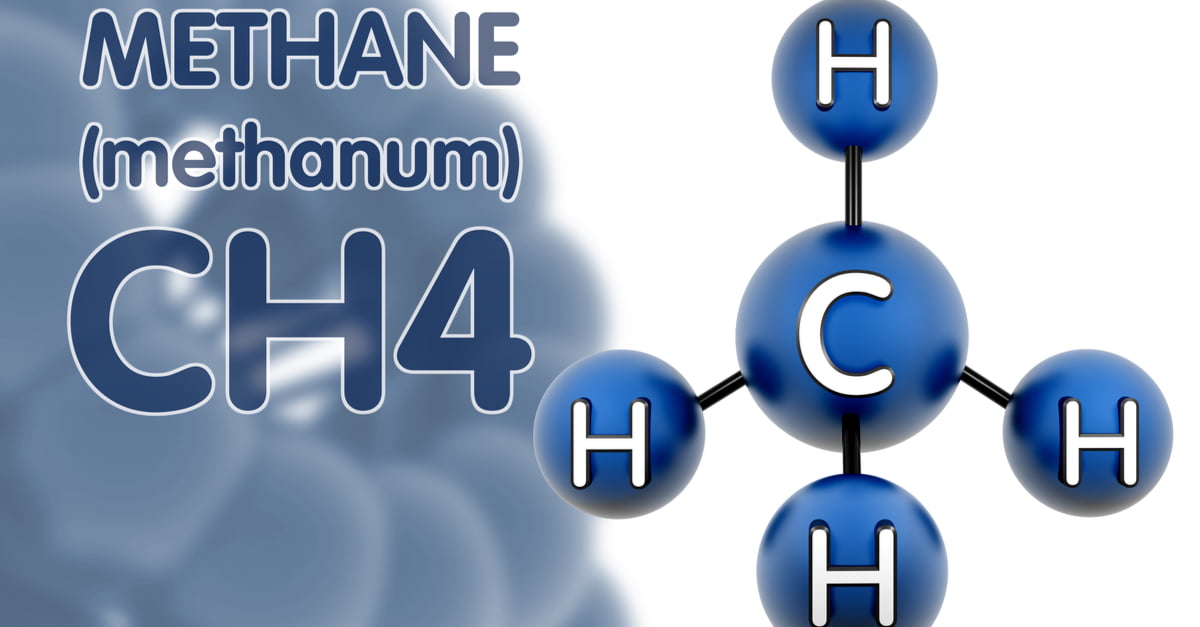
Công thức phân tử: CH4
Phân tử khối của Metan (CH4) bằng 16 đvC.
Cấu tạo phân tử:
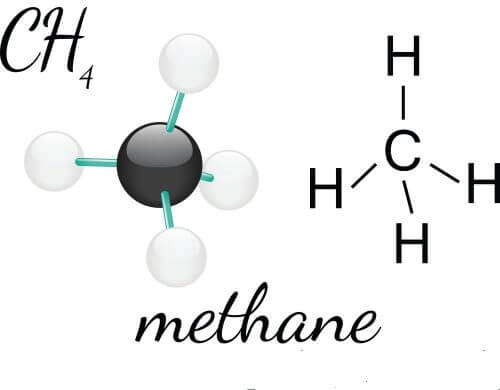
Trong phân tử metan chỉ có 4 liên kết đơn.
Những hiđrocacbon mạch hở, phân tử chỉ có liên kết đơn giống như metan gọi là ankan, công thức chung là CnH2n 2, với n ≥ 1.
2. Tính chất vật lý Metan là gì?

Metan (CH4) mang những tính chất vật lý sau đây:
- Metan là chất khí không màu, không mùi, không vị, ít tan trong nước.
- Tỉ khối của metan so với không khí là dCH4/không khí = 16/29.
- Nó là một loại khí rất độc và dễ cháy, tạo ra ngọn lửa màu xanh khi đốt cháy.
- Khí metan hóa lỏng ở -162°C và hóa rắn ở -183°C.
- Điểm bắt lửa: 537 °C.
- Khối lượng riêng của khí metan là 0,717 kg/m3.
- Metan không hòa tan trong dung môi phân cực vì không có liên kết hydro, nhưng nó hòa tan trong dung môi không phân cực.
- Metan không dẫn điện.
3. Tính chất hóa học Metan là gì?
Trên thực tế, khí metan có nhiều tính chất hóa học khác nhau. Tuy nhiên, metan có 2 tính chất đặc biệt và nổi bật nhất, đó là khả năng phản ứng với oxy và clo trong các điều kiện phản ứng khác nhau.
3.1. Tác dụng với oxi

Thí nghiệm: Đốt metan với oxi
Quan sát:
- Sau khi đánh lửa, quan sát thấy những giọt nước dính vào ống nghiệm.
- Cho nước cất vào ống nghiệm sau khi nung thấy xuất hiện kết tủa trắng.
- Ống nghiệm trở nên nóng.
Phần kết luận:
- Quá trình đốt cháy khí metan sinh ra khí cacbonic và hơi nước.
- Phản ứng toả nhiều nhiệt.
- Phương trình hóa học: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) (ở điều kiện nhiệt độ)
Chú ý: Hỗn hợp một thể tích khí metan và hai thể tích khí oxi là hỗn hợp gây nổ mạnh.

3.2. Tác dụng với clo
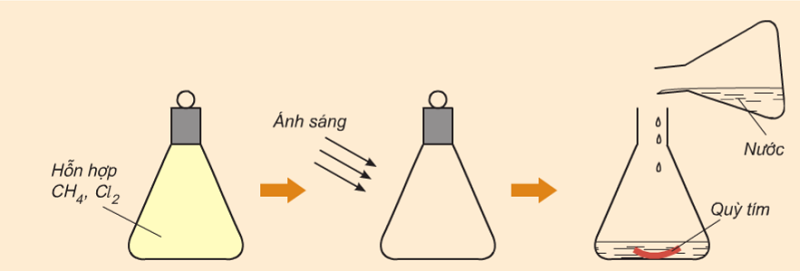
Thí nghiệm: Cho hỗn hợp khí metan và clo phản ứng với nhau trong bình kín, điều kiện có chiếu sáng.
Quan sát:
- Ban đầu hỗn hợp khí có màu vàng là clo. Theo thời gian, màu vàng nhạt dần và biến mất.
- Thêm nước và nhúng giấy quỳ tím vào dung dịch, giấy quỳ chuyển sang màu đỏ.
Phần kết luận:
- Metan phản ứng với clo khi có ánh sáng, tạo ra sản phẩm có tính axit, do đó làm cho giấy quỳ tím chuyển sang màu đỏ.
- Phương trình hóa học: CH4 + Cl2 → HCl + CH3Cl (clometan)
- Trong phản ứng này, nguyên tử hydro của metan được thay thế bằng nguyên tử clo, do đó nó được gọi là phản ứng thay thế. Nếu dùng khí clo dư thì toàn bộ nguyên tử hiđro trong phân tử metan có thể bị thay thế hoàn toàn bằng nguyên tử clo.
4. Phương pháp điều chế khí metan như thế nào?
Có nhiều cách để tổng hợp khí metan, nhưng loại khí này được tổng hợp và sử dụng phổ biến nhất trong hai môi trường phổ biến: môi trường phòng thí nghiệm và công nghiệp.
4.1. Điều chế metan trong phòng thí nghiệm
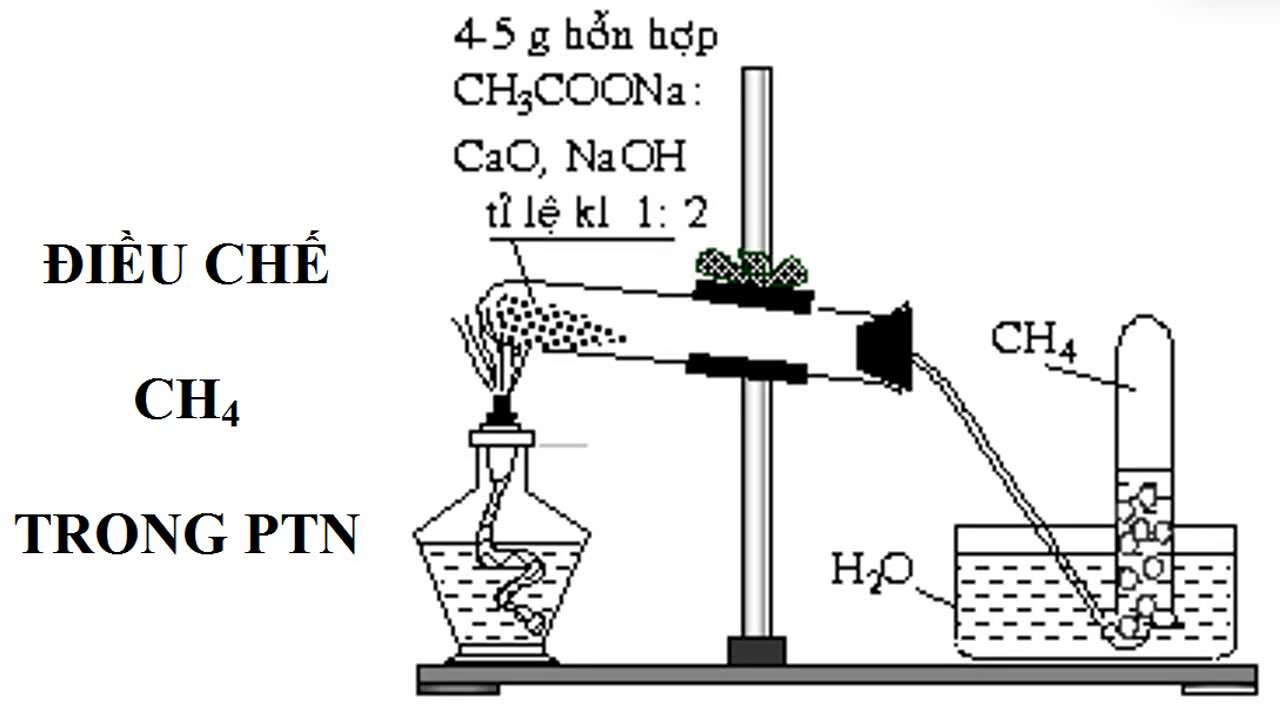
Có một số phương pháp phổ biến để tổng hợp CH4 trong môi trường phòng thí nghiệm, chẳng hạn như đun nóng natri axetat với axit sunfuric hoặc sử dụng cacbua magiê để phản ứng với nước.
- Điều chế CH4 từ nhôm cacbua:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
- Phản ứng muối natri axetat với xút tạo khí metan (nhiệt phân muối natri của axit cacboxylic):
CH3–COONa + NaOH →(CaO, nhiệt độ) Na2CO3 + CH4
- Cách điều chế metanol bằng phản ứng cộng hidro vào cacbon:
C + 2H2 →(nhiệt độ, Ni) CH4
- Cách điều chế CH4 từ khí CO:
CO + 3H2 →(nhiệt độ) H2O + CH4
Hoặc điều chế CH4 bằng cách khử các dẫn xuất methyl của các halogen, ancol hay carbonyl.
4.2. Điều chế metan trong công nghiệp
Trong công nghiệp, khí metan và các dẫn xuất của nó được chiết xuất từ khí đốt tự nhiên và dầu mỏ. Đây là cách hiệu quả nhất và nhanh nhất để tinh chế CH4.
5. Ứng dụng của khí metan

Khí metan là một trong những nguyên liệu quan trọng và không thể thiếu trong sản xuất công nghiệp và sinh hoạt hàng ngày của con người.
5.1. Ứng dụng trong nhiên liệu

Metan là nguồn tài nguyên quan trọng được sử dụng rộng rãi trong các quá trình công nghiệp và đời sống hàng ngày của con người do khả năng sinh nhiệt cao. Nó được chọn làm nguồn nhiên liệu để phát điện, sưởi ấm và cung cấp năng lượng cho các phương tiện.
- Ngoài ra, metan được sử dụng trong các hệ thống sưởi ấm như lò nướng, nhà ở, hệ thống nước nóng và lò nung bằng cách đốt cháy oxy để tạo ra nhiệt.
- Metan cũng đóng một vai trò quan trọng trong sản xuất điện khi được đốt cháy làm nhiên liệu trong tuabin khí. Trong các nhà máy nhiệt điện, metan được tận dụng làm nhiên liệu kết hợp với hơi nước để sản xuất điện hiệu quả, giảm thiểu ô nhiễm môi trường.
- Với hàm lượng mêtan lên tới 98% trong khí tự nhiên, metan cũng là nguồn nhiên liệu khả thi cho ô tô và các phương tiện khác.
Tuy nhiên, khí metan và các nhiên liệu khí khác có mật độ năng lượng thấp. Ở điều kiện bình thường, nhiệt trị của 1 lít khí metan vào khoảng 33-36 kJ. Mặt khác, nhiệt lượng thu được sau quá trình đốt cháy 1 lít xăng là 31.400 kJ, lớn hơn khí metan hơn 1000 lần. Do đó, các nhà nghiên cứu có thể khẳng định rằng khí metan có thể được sử dụng làm nhiên liệu cho động cơ đốt trong ở dạng nén hoặc lỏng.
Các phân tích về sự độc hại của ô tô chạy bằng khí gas đã cho thấy kết quả khả quan khi thay thế xăng bằng khí metan. Sự phát thải các thành phần độc hại (đo bằng g/km) giảm đáng kể: carbon monoxide giảm 5-10 lần, hydrocarbon giảm 3 lần và nitơ oxit giảm 1,5-2,5 lần.
Ngoài ra, ở nhiều nơi, khí metan còn được gọi là “khí đốt tự nhiên” và các hệ thống đường ống được lắp đặt để cung cấp nhiệt và nấu ăn.
5.2. Ứng dụng trong công nghiệp
Khí metan hiện đang được sử dụng trong các phản ứng công nghiệp khác nhau và được vận chuyển an toàn dưới dạng khí lỏng.
Trong công nghiệp hóa chất, metan là nguyên liệu chính dùng để sản xuất hydrocacbon, metanol, các loại axit axetic, axit fomic.
Metan là một thành phần quan trọng trong việc sản xuất hydro thông qua phản ứng:
CH4 + H2O (nhiệt độ, áp suất) → CO2 + H2
Nó cũng là nguồn chính để tổng hợp than hoạt tính và các hóa chất khác nhau như metanol, axit axetic và axit formic.

 Ống inox
Ống inox Ống thép
Ống thép Ống đồng
Ống đồng Ống nhựa
Ống nhựa